
于海军、李亚平合作构建免疫检查点抗体药物递送系统
日期【2019-08-04 11:00】 共阅:【】次
免疫检查点抗体药物能够激活部分肿瘤患者的免疫效应,显著延长肿瘤患者生存期。但是免疫检查点疗法却对大多数肿瘤患者响应率较低(总体响应率低于30%),其中一个重要原因就是肿瘤组织内细胞毒性T淋巴细胞浸润程度低导致免疫耐受。同时,免疫检查点抗体药物正常组织表达的受体也有识别作用,易造成非肿瘤靶向分布(on-target but off-tumor),从而引发严重的免疫相关毒副作用。如何消除肿瘤免疫耐受、提高免疫检查点抗体药物的临床响应率并降低其毒副作用已成为改善免疫检查点疗法的重大基础及临床问题。
针对上述关键挑战,于海军研究员和李亚平研究员合作发展了一种肿瘤微环境激活型免疫检查点抗体药物递送系统,为改善肿瘤免疫耐受提供了新思路。该抗体药物递送系统通过疏水相互作用共包载光敏剂分子ICG和PD-L1免疫检查点抗体(αPD-L1),形成粒径约为150 nm的纳米颗粒。该包含聚乙二醇外壳的抗体纳米粒可在血液中稳定循环并屏蔽巨噬细胞和网状内皮系统的清除作用,同时可避免αPD-L1与正常组织PD-L1的结合,抑制免疫相关毒副作用。
到达肿瘤后,抗体纳米粒在肿瘤微环境基质金属蛋白酶作用下特异性切除聚乙二醇外壳,增加抗体纳米粒的瘤内蓄积并延长滞留时间,实现αPD-L1瘤内缓慢释放。在808 纳米波长近红外光照射下,ICG光敏剂可发挥光动力效应,生成活性氧诱导肿瘤部位炎症反应,提高肿瘤免疫原性,促进细胞毒性T淋巴细胞瘤内浸润。体内抗肿瘤实验和相关免疫机制研究表明,基于抗体纳米粒的抗体药物递送策略可有效消除4T1三阴性乳腺癌的免疫耐受,抑制4T1乳腺癌原位瘤生长和肺转移。该研究工作进一步揭示了肿瘤免疫耐受对肿瘤免疫检查点疗法的负调控作用,为有效改善肿瘤免疫检查点疗法提供了新的解决方案。
该研究工作于2019年7月12日在线发表于免疫学领域权威期刊Science Immunology。王当歌助理研究员为论文第一作者,于海军研究员和李亚平研究员为论文通讯作者。该研究由中科院上海药物所、烟台药物所、烟台市纳米药物与高端制剂重点实验室等单位合作完成。
全文链接:https://immunology.sciencemag.org/content/4/37/eaau6584
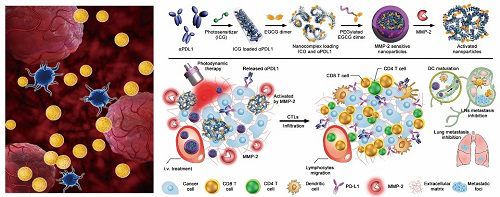
肿瘤微环境激活型抗体纳米粒用于免疫联合治疗的原理示意图
附专家点评:

李斌 (上海交通大学特聘教授,国家基金委免疫学“杰青”)
免疫疗法是继外科手术、化疗、放疗之外,被病人及临床专家皆赋予厚望的抗肿瘤临床治疗新手段。免疫检查点疗法继2013年被Science杂志列为年度新突破,2018年相关领域基础免疫学家也因之获得了诺贝尔医学或生理学奖。迄今为止,已有多家制药公司的针对免疫检查点的PD-1抗体及PD-L1抗体药物上市,用于黑色素瘤及肺癌等实体瘤的临床治疗,并已取得显著临床疗效。遗憾的是,就算最好的抗体药物,针对包括肺癌患者在内的各种晚期实体肿瘤的五年临床生存率也从来没有超过30%。如何提高免疫检查点抗体治疗的五年临床生存率,依然是我们面临的重大科学及临床问题。
于海军研究员和李亚平研究员的本篇研究论文,巧妙地利用近红外光激活肿瘤微环境免疫细胞动态再平衡,通过新型纳米颗粒递送系统实现肿瘤微环境特异性递送抗体药物如PD-L1抗体,从而为如何提高抗肿瘤免疫疗效提供了创新性方法手段。本文体外及体内抗肿瘤疾病模型中观察到的显著疗效也为我们进一步设计临床实验提供了振奋人心的新希望。该课题的设计思路可以应用到多种实体瘤免疫治疗,比如可以根据不同实体瘤组织微环境表达的可激活纳米颗粒递送系统的酶类表达特异性,选择相应的可被切割链接序列,可根据不同实体瘤免疫检查点分子表达情况选择不同的抗体药物,还可进一步改善比近红外光更有效能深度激活人体组织内肿瘤微环境免疫状态的物理或化学手段等。此外,不同肿瘤组织微环境的复制程度及药物靶点差异很大,基于以上所述原则,结合临床肿瘤组织微环境单细胞测序结果指导下的药物模块化设计,将有可能为我们的实体瘤临床免疫治疗提供新策略和新突破。
